地址:浙江省杭州市西湖区浙江大学紫金港校区
联系人:董老师
邮箱:dong.hy@zju.edu.cn

地址:浙江省杭州市西湖区浙江大学紫金港校区
联系人:董老师
邮箱:dong.hy@zju.edu.cn

2020年11月11日,浙江大学基础医学院/浙江省良渚实验室/浙江省生物化学与分子生物学学会理事张进团队与浙江大学药学院翁勤洁团队以及浙江大学附属第一医院黄河团队联合在Journal of Hematology & Oncology (IF: 11.059) 杂志上发表标题为Pluripotent Stem Cell-derived CAR-Macrophage Cells with Antigen-dependent Anti-Cancer Cell Functions的文章,首次报道了基于诱导多能干细胞 (iPSC) 分化的表达嵌合抗原受体的巨噬细胞 (CAR-iMac) 在肿瘤的免疫细胞治疗中的应用。

嵌合抗原受体T细胞免疫疗法 (CAR-T therapy) 是近年来发展非常迅猛的一种新型细胞免疫治疗技术,它在肿瘤治疗尤其是某些血液肿瘤方面有十分显著的治疗效果。但该疗法也存在诸多挑战,包括T细胞难以浸润实体肿瘤,在复杂的肿瘤微环境中被抑制且产生耗竭,对原代T细胞进行基因修饰效率有限且获得的细胞具有较高的异质性、以及由于个性化制造过程导致的高额成本[1]。为了克服这些障碍,研究人员采用各种策略,包括优化嵌合抗原受体、改进T细胞的功能、优化T细胞亚群比例或采用其他类型免疫细胞[2-3],以及制造“现货”通用T细胞等。
在该项研究中,浙江大学的研究人员开发了诱导多能干细胞iPSC分化得到的表达CAR的巨噬细胞(CAR-expressing iPSC-derived Macrophage, CAR-iMac) 用于肿瘤免疫细胞治疗。诱导多能干细胞(induced pluripotent stem cell, iPSC)由人体外周血单核细胞经过重编程产生,具有分化成为多种体细胞的潜能,由于其来自病人本身、易于扩增、且具有单克隆基因修饰/编辑的便利性等优点,受到广泛的关注,近年来得到了迅速的发展,其中一个重要的应用即是分化为免疫细胞。之前有研究报道利用iPSC分化得到CAR-T和CAR-NK 细胞[4-5],它们对血液瘤和实体瘤都具有很好的杀伤效果。
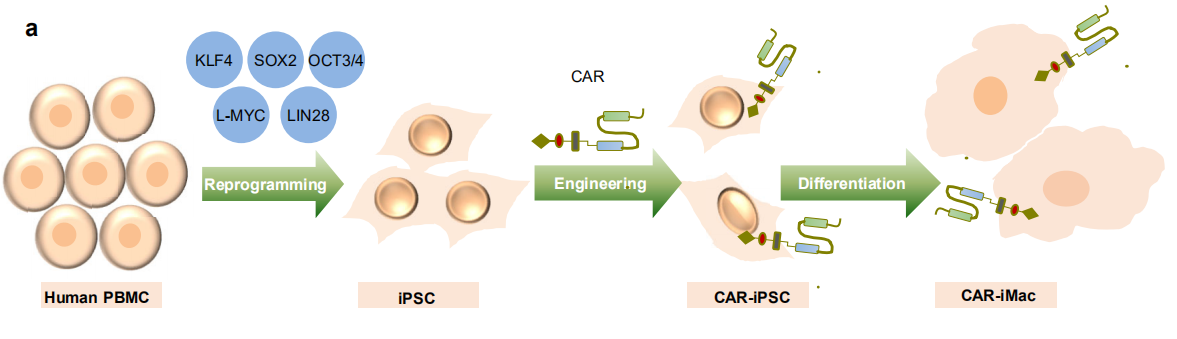
本研究利用iPSC的以上特性,得到的CAR-iMac细胞不仅具有很高的产率(>50x) 和纯度(接近100% CD11b/CD14阳性),而且具有巨噬细胞的基因表达谱以及成熟巨噬细胞的吞噬、极化等功能。对分化产物的单细胞转录组测序分析以及拟时间分析显示分化路径从多能干细胞到造血干祖细胞,再到巨噬细胞与DC细胞。当与表达CD19抗原的淋巴瘤细胞或表达mesothelin抗原的卵巢癌细胞共培养时,CAR-iMac细胞展现出抗原依赖性的吞噬和杀伤肿瘤细胞的功能,以及抗原依赖性的向M1型巨噬细胞极化的功能(此前大量研究表明促进炎症的M1型巨噬细胞有助于抑制肿瘤,而抑制炎症的M2型巨噬细胞促进肿瘤发展)。CAR-iMac细胞在小鼠的血液肿瘤和实体肿瘤模型中也展现出抗原依赖性的抑制肿瘤细胞生长的能力。“这就好像给巨噬细胞装上了一个“人脸识别”系统,当其遇见带有抗原的肿瘤细胞时,就会被激活”,张进研究员说。该研究为肿瘤细胞免疫治疗提供了新的思路和广阔的应用前景。
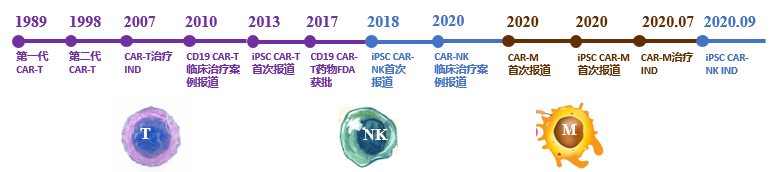
目前,人类iPSC来源的CAR-T, CAR-NK, CAR-M已经先后问世,并开始逐渐向临床转化。其中iPSC CAR-NK细胞已经开始了在B细胞淋巴瘤和慢性淋巴细胞白血病的临床试验。相信未来更多iPSC来源的免疫细胞在肿瘤免疫细胞治疗中会拥有广阔的应用前景。
医学院博士研究生张丽和博士后田琳、余华以及药学院代晓阳和博士生王佳佳为文章的共同第一作者,张进研究员、黄河教授和翁勤洁副教授为本文的通讯作者。本项目受到科技部重点研发计划项目、国家自然科学基金、浙江省自然科学基金、浙江省创新团队的支持,以及系统医学与精准诊治浙江省实验室(良渚实验室)、浙江大学医学中心和浙江大学血液研究所的支持。
参考文献
1. June CH & Sadelain M, Chimeric Antigen Receptor Therapy. The New England journal of medicine 379, 64-73 (2018).
2. Klichinsky M, et al., Human chimeric antigen receptor macrophages for cancer immunotherapy. Nature Biotechnology (2020).
3. Noy R & Pollard JW, Tumor-associated macrophages: from mechanisms to therapy. Immunity 41, 49-61(2014).
4 Themeli M, et al., Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nat Biotechnol 31, 928-933 (2013).
5. Li Y, Hermanson DL, Moriarity BS, & Kaufman DS, Human iPSC-Derived Natural Killer Cells Engineered with Chimeric Antigen Receptors Enhance Anti-tumor Activity. Cell Stem Cell 23, 181-192 e185 (2018).